在现实世界中,人们发现跨膜蛋白嵌入到所有细胞和细胞器的膜中。这些跨膜蛋白对它们正常运作是至关重要的。比如,许多天然存在的跨膜蛋白充当着特定物质穿过生物膜的通道。一些跨膜蛋白接收或传输细胞信号。鉴于这样的作用,许多药物旨在靶向跨膜蛋白并改变它们的功能。
但是理解跨膜蛋白如何组合在一起以及它们是如何发挥作用的是充满挑战性的。鉴于它们在嵌入细胞膜时发挥作用,跨膜蛋白要比在水溶液中发挥作用的组成细胞质或胞外液的蛋白更难研究。
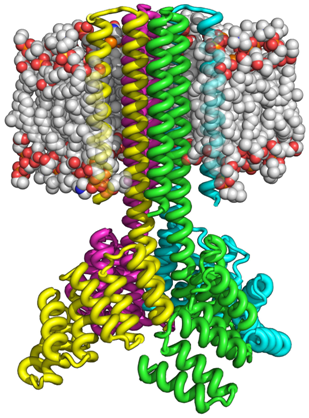
在一项新的研究中,美国华盛顿大学蛋白质设计学院主任、华盛顿大学蛋白质设计医学院生物化学教授David Baker、Baker实验室高级研究员Peilong Lu及其同事们开发出一种被称作Rosetta的计算机程序,这种计算机程序能够预测一种蛋白在合成后将要折叠出的结构。相关研究结果发表在2018年3月2日的Science期刊上,论文标题为“Accurate computational design of multipass transmembrane proteins”。
图片来自华盛顿大学蛋白质设计学院
蛋白的结构是至关重要的,这是因为蛋白的结构决定着它的功能。一种蛋白的形状是通过组成它的氨基酸之间的复杂相互作用和这些氨基酸与周围环境之间的复杂相互作用形成的。最终,这种蛋白呈现出最佳地平衡所有这些因素的形状,从而使得它达到尽可能低的能量状态。
Lu和他的同事们采用的Rosetta程序能够通过考虑这些相互作用和计算最低的整体能量状态来预测一种蛋白的结构。这种程序能够为一条氨基酸链构建出数万种结构模型,随后鉴定出具有最低能量状态的结构模型。这些研究人员证实由此获得的结构模型准确地代表着这条氨基酸链在天然状态下可能会呈现出的结构。
确定跨膜蛋白的结构是较为困难的,这是因为它们的一部分必须跨过由脂质组成的生物膜内部。
在水溶液中,具有极性侧链的氨基酸残基(在某些生理条件下可能带电荷或者参与氢键形成的组分)往往位于蛋白表面上,在那里它们能够与水分子相互作用,从而使得蛋白分子的侧边携带负电荷或正电荷。因此,蛋白表面上的极性氨基酸残基是亲水性的。
另一方面,非极性氨基酸残基往往在远离极性水溶液的蛋白内核中包装在一起。这样的氨基酸残基是疏水性的。因此,蛋白的亲水性氨基酸残基和疏水性氨基酸残基与周围水溶液之间的相互作用有助促进蛋白折叠并让蛋白的最终结构保持稳定。
然而,膜中的蛋白折叠更为复杂,这是因为膜的脂质内部是非极性的,即它没有发生电荷分离。这意味着若要在膜中保持稳定,跨膜蛋白必须在它的表面上放置非极性的疏水性氨基酸残基,并且将它的极性的亲水性氨基酸残基包装在它的内部。随后,它必须在它的内核中的亲水性氨基酸残基之间建立化学键来让它的结构保持稳定。
Lu说,解决这个问题的关键在于利用Baker实验室开发出的一种方法来设计蛋白,从而使得极性的亲水性氨基酸残基以一种足以形成极性-极性相互作用的方式在膜内部组装,这就从膜内部将蛋白连接在一起。
利用这种方法,Lu和他的同事们能够通过使用多达215个氨基酸在细菌和哺乳动物细胞内制造事先设计的跨膜蛋白。所制造的蛋白经证实是高度热稳定的并且能够在膜表面上正确地自我定位。正如天然存在的跨膜蛋白一样,这些蛋白是多跨膜的,这意味着它们能够多次穿过膜,并组装成稳定的多蛋白复合物,如二聚体、三聚体和四聚体。
Lu说,“我们证实如今准确地设计复杂的能够在细胞中表达的多跨膜蛋白是有可能的。这将使得研究人员设计具有全新结构和功能的跨膜蛋白是有可能的。”
(文章来源生物谷)