全国服务热线400-689-6719
医学行业动态
中洪博元生物技术报道
许多被称作核RNA结合蛋白(RBP)的特殊分子,当错误地被放置在细胞核外面时,会形成包括额颞叶痴呆症(FTD)和肌萎缩性脊髓侧索硬化症(ALS)在内的几种脑部疾病中观察到的有害蛋白团块。由这些致病性蛋白形成的团块含有导致神经细胞损伤的粘性原纤维。为此,人们想要逆转这些团块的形成,并将RBP蛋白重新放回细胞核内的适当位置上。
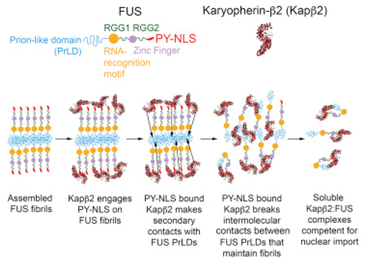
论文共同作者、Shorter实验室博士生Charlotte Fare说,“考虑到这种复杂性,我们如今正在努力寻找一种方法来增加NIR蛋白在具有蛋白团块的神经元中的表达,比如利用基因工程方法或小分子药物。”
(文章来源生物谷)
上海展辉生物技术有限公司
地址:上海市浦东新区东方路
联系电话:400-689-6719
联系邮箱:3369352092@qq.com
联系我们:
4006896719

扫一扫
关注东洪博元更多动态