生物学行业动态Industry dynamic
在一项新的研究中,来自美国加州大学洛杉矶分校(UCLA)和科罗拉多大学丹佛分校的研究人员解析出一种大型的被称作剪接体(spliceosome)的细胞机器的高分辨率结构。在我们理解之前并不清楚的RNA剪接过程中,这一发现填补了最后一个重大的缺口。
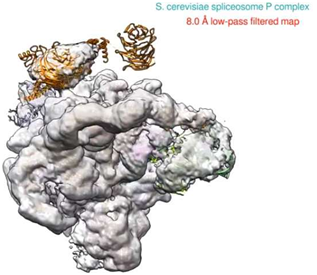
这些研究人员解析出的酵母P状态剪接体(spliceosome P complex)的分辨率为3.3埃的低温电镜(cryo-EM)原子结构图于2017年11月16日在线发表在Science期刊上,论文标题为“Structure of the yeast spliceosomal postcatalytic P complex”。论文通信作者为科罗拉多大学丹佛分校的Rui Zhao和加州大学洛杉矶分校加州纳米系统研究所电子成像纳米机器中心主任Z. Hong Zhou教授。论文第一作者为Zhou实验室的博士后研究员Shiheng Liu和Zhao实验室的Xueni Li。
DNA包含着细胞运作的蓝图,但是遗传密码必须先经转录产生RNA才能够将这种蓝图含有的指令传递给细胞。这种初始的RNA转录本混杂着来自我们的基因组中的无用的或“垃圾”的RNA片段(被称作内含子),这些内含子必须被移除或者说剪接掉才能够传递正确的指令。剪接体是一种巨大的分子机器,由5种小分子非编码RNA和100多种蛋白组成。它移除这种RNA转录本中的内含子,从而使得仅有用的片段(被称作外显子)保留下来。这些外显子被重新连接在一起从而产生最终的信使RNA(mRNA)。mRNA经翻译后产生蛋白。
当剪接体发挥作用时,它发生着显著的变化。总体而言,已知剪接体的至少7种状态执行着特定的功能。这一发现以高分辨率细节地阐明了P状态剪接体参与正确地识别需要切割的RNA,将这些外显子连接在一起和在切割后释放出这种RNA。
Liu说,“我们在理解剪接体如何发挥作用方面取得很大的进展,但是我们仍然面临的最大挑战之一就是理解外显子如何从它的活性位点上脱离下来。”
Liu说,“关于这种P状态剪接体,存在着很多问题。这一发现有助人们更好地理解这个完整的RNA剪接周期。”
RNA剪接中的错误会引起大量的人类疾病,这突出强调了了解这种剪接体的复杂功能的重要性。
更为重要的意义是,这项研究为基于结构的靶向生化实验打开大门。如今随着这种剪接体的几乎所有主要组分的原子结构为人们所了解,一种完整的机制上的理解可能很快就会实现。
(本文转载生物谷)
上海展辉生物技术有限公司
地址:上海市浦东新区东方路
联系电话:400-689-6719
联系邮箱:3369352092@qq.com
联系我们:
4006896719

扫一扫
关注东洪博元更多动态