生物学行业动态Industry dynamic
针对PD-1的免疫检查点疗法(2018年诺贝尔生理学或医学奖)最新研究进展
2018年10月2日/生物谷BIOON/---昨天(北京时间10月1日),2018年诺贝尔生理学或医学奖揭晓,来自德克萨斯大学的研究者James P.Allison教授和日本京都大学的Tasuku Honjo教授因发现抑制负向免疫调节的新型癌症疗法(前者发现针对CTLA-4的免疫检查点疗法,后者发现针对PD-1的免疫检查点疗法)而获得此奖。(PD-1的免疫检查点疗法)
20世纪90年代,当研究者James P. Allison在加利福尼亚大学的实验室从事研究期间,他对T细胞蛋白CTLA-4进行了深入研究,其是发现蛋白CTLA-4能作为T细胞制动器角色的科学家之一,如今其它研究小组正在研究阐明是否该蛋白能作为治疗自身免疫性疾病的靶点;而研究者Allison有着完全不同的想法,他开发出了一种特殊抗体,能够结合CTLA-4并且阻断其功能(见图),如今他正在研究想要阐明是否阻断CTLA-4蛋白的功能能够释放T细胞的制动,同时释放免疫系统攻击癌细胞的能力。Allison与其同事于1994年进行了首轮试验,随后他们又对实验进行了重复,结果让人不可思议,研究者所开发的特殊抗体能够抑制制动器并且释放机体免疫系统的抗肿瘤T细胞活性,从而成功治疗了癌症小鼠。
1992年,在研究者Allison发现CTLA-4之前,来自日本的研究者Tasuku Honjo就发现了PD-1,其是T细胞表面另外一种特殊蛋白,多年来研究者Honjo一直在探索其功能,他表示,PD-1与CTLA-4相似,其也能作为T细胞的制动器,但却有着另外一套作用机制。在动物实验中,阻断PD-1或许能作为抵御癌症的新型疗法;为此研究人员也试图利用PD-1来有效治疗癌症患者,2012年的一项关键研究明确了治疗多种不同类型癌症的疗效;研究结果非常显著,研究人员成功治疗了一些转移性的癌症患者,同时让患者的疾病症状得到了长期缓解,而这在以前基本是无法实现的。
最初的研究中,研究人员阐明了阻断CTLA-4和PD-1的效果,而且其临床治疗效果非常显著;研究人员将其称之为免疫检查点疗法(immune checkpoint therapy),该疗法能够有效改变恶性癌症患者的治疗结局;与其它癌症疗法类似,这种疗法也会产生严重的副作用,有时候甚至会危及患者生命,而这些副作用是由过度免疫反应所诱发的自身免疫反应所致,但其是可以进行控制的,如今研究人员一直在深入研究来阐明该疗法背后所设计的分子机制,他们希望后期能够开发出副作用较小的改进版疗法。
如今,有四种成熟的药物用于免疫检查点疗法中,它们分别是作为CTLA-4抑制剂的易普利姆玛(ipilimumab)和tremelimumab,以及作为PD-1抑制剂的派姆单抗(pembrolizumab)和纳武单抗(nivolumab)。在此,小编就针对PD-1的免疫检查点疗法在近期取得的进展进行一番盘点,以飨读者。
1.Nature:重磅!揭示癌细胞抑制抗肿瘤免疫反应新机制---从远处释放携带PD-L1的外泌体
doi:10.1038/s41586-018-0392-8
癌细胞并不仅仅是一群生长失去控制的细胞;为了自身的生存,它们积极地参与与免疫系统之间的斗争。能够逃避免疫系统检测是癌症的一种特征。在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现癌细胞释放生物“无人机”---在血液中循环的被称作外泌体 (exosome)的小囊泡,这些小囊泡携带着PD-L1蛋白,这种蛋白导致T细胞在到达肿瘤并进行战斗之前精疲力竭---来协助这种斗争。尽管这项研究主要针对转移性黑色素瘤,但是这些研究人员发现乳腺癌和肺癌也会释放携带着PD-L1的外泌体。相关研究结果于2018年8月8 日在线发表在Nature期刊上,论文标题为“Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”。论文通信作者为宾夕法尼亚大学文理学院生物学教授Wei Guo博士和宾夕法尼亚大学佩雷尔曼医学院病理学与实验室医学 教授Xiaowei Xu博士。
图片来自The labs of Wei Guo, PhD, and Xiaowei Xu, MD, PhD, University of Pennsylvania。
这项研究以一种颠覆现有观念的方式展示了癌症如何采取一种系统性方法来抑制免疫系统。此外,它还指出了一种新方法来预测哪些癌症患者会对通过破坏免疫抑制来抵抗肿瘤的抗PD1疗法(anti-PD1 therapy)作出反应,并提供一种追踪这类疗法治疗效果的方法。
癌症治疗中最成功的创新之一是使用免疫检查点抑制剂药物,这类药物旨在阻止癌细胞抑制免疫系统而让肿瘤茁壮成长和扩散的企图。这类药物的主要靶标之一是PD-1,即一种位于T细胞表面上的蛋白。在肿瘤细胞的表面上,它们表达一种被称为PD-L1的对应分子,它与T 细胞表面上的PD-1蛋白相互作用,有效地关闭了T细胞的抗癌反应。使用免疫检查点抑制剂阻断这种相互作用让T细胞重新活跃,从而允许它们在肿瘤中能够释放出杀伤癌细胞的能力。
尽管已知癌细胞在它们的表面上携带PD-L1,但是在这项新的研究中,这些研究人员发现来自人类黑色素瘤细胞的外泌体也在它们的表面上携带着PD-L1。外泌体PD-L1可直接结合T细胞并抑制这些T细胞的功能。鉴定出肿瘤细胞分泌的外泌体PD-L1为免疫检查点机制提供了 一次重大更新,并对肿瘤免疫逃避提供了新见解。
2.Nat Med:科学家发现决定免疫检查点疗法抗癌疗效的关键因素
doi:10.1038/s41591-018-0085-8
肿瘤内刺激性树突状细胞(stimulatory dendritic cells,SDCs)在刺激细胞毒性T淋巴细胞和促进对抗癌症的免疫反应中发挥着关键作用。研究调节SDCs在肿瘤微环境(tumor microenvironment,TME)中富集情况的机理将提供新的治疗策略。
为此,来自加州大学旧金山分校等机构的研究人员研究了人黑素瘤中的SDCs的富集及其影响因素,结果发现人黑素瘤中SDC的富集与肿瘤内编码细胞因子FLT3LG的基因的表达相关,相关研究成果于近日发表在《Nature Medicine》上,题为“A natural killer–dendritic cell axis defines checkpoint therapy–responsive tumor microenvironments”。
FLT3LG主要由小鼠和人肿瘤中的淋巴细胞——尤其是天然杀伤(natural killer,NK)细胞分泌。NK细胞可以在小鼠TME中与SDCs形成稳定的偶联物。通过使用遗传学手段或者药物清除小鼠体内的NK细胞,研究人员发现NK细胞在通过产生FLT3L正面调节SDCs在肿瘤中的富 集过程中发挥着关键作用。
研究人员还发现,尽管抗PD-1免疫检查点疗法主要靶向T细胞,但是NK细胞通常与人肿瘤中的保护性SDCs的含量、病人对抗PD-1疗法的响应以及病人总生存期延长有关。
3.Nat Med:如何更有针对性地使用癌症免疫疗法并提高其治疗成功率?
doi:10.1038/s41591-018-0057-z
如今,越来越多的医生都通过刺激患者的免疫系统来帮其对抗癌症,日前,一项刊登在国际杂志Nature Medicine上的研究报告中,来自巴塞尔大学医学院的科学家们通过研究开发了一种新方法来预测患者接受癌症疗法的成功率。
免疫疗法能够改变患者的免疫系统从而帮助其攻击癌细胞,要么摧毁癌细胞,要么阻止癌细胞生长,但这种疗法仅在一小部分患者身上有作用,这项研究中,研究人员阐明了如何更好地预测哪些患者会对疗法产生反应,哪些患者对疗法并没有反应。关键在一种名为PD-1 的蛋白质,其位于人类免疫细胞表面,直到最近研究人员才发现,PD-1或是癌细胞的致命弱点,因为癌细胞能够吸附该蛋白,从而保护其免于患者机体免疫系统的攻击,我们也可以认为,癌细胞穿上了一身迷彩服,而免疫疗法就能够阻断癌细胞的吸附位点,以便免疫细 胞能够发现癌细胞并对其攻击。
这项研究中,研究人员发现,携带较多PD-1的免疫细胞能够最好地检测到肿瘤所在,此外,这些富含PD-1的细胞也能够分泌特殊的信号化学物质来吸引额外的免疫细胞帮助抵御癌症;因此这些患者或许对免疫疗法的反应较好。
4.Cancer Res:联合阻断VEGF和PD-L1或可增强肺癌治疗效果
doi:10.1158/0008-5472.CAN-17-2176
小细胞肺癌是肺部肿瘤的重要组成部分,具有恶性程度高,倍增时间短,转移早而广泛等特点,虽然对化疗等方法敏感但极易发生耐药和复发,并且这种疾病常在发展到晚期才被诊断出来,导致病人的生存受到严重限制。在过去几十年里,对小细胞肺癌发生的分子机制研究较多,提示可能存在多种基因参与小细胞肺癌的发生。如何提高对小细胞肺癌的治疗效果成为困扰医生和科学家们的一个难题,最近来自德国的研究人员发现了一种联合靶向疗法能够达到提高治疗效果的目的。相关研究结果发表在国际学术期刊Cancer Research上。
在这项研究中,研究人员发现在一个小细胞肺癌的小鼠模型中,抗VEGF和抗PD-L1靶向药物联合使用比单独使用抗PD-L1和抗VEGF药物具有更好的效果。接受抗PD-L1药物单独治疗的小鼠在治疗后三周出现复发,这些小鼠还伴随着肿瘤相关PD-1/TIM-3双阳性T细胞疲劳的表 型。因阻断PD-L1而出现的T细胞疲劳表型在给予抗VEGF靶向治疗后得到减弱。
研究人员进一步证实对抗PD-L1治疗产生适应性抵抗的小细胞肺癌病人的PBMC细胞中存在类似的TIM-3阳性T细胞表型。研究人员还从机制上进行研究,发现VEGF-A能够增强T细胞上抑制性受体TIM-3的共表达,表明在对小细胞肺癌病人进行抗PD-1靶向治疗过程中VEGF发挥了 免疫抑制作用。
5.Lancet Oncol:免疫治疗药物的疗效竟存在性别差异!
doi:10.1016/S1470-2045(18)30261-4; doi:10.1016/S1470-2045(18)30270-5
根据一项新的研究,来自意大利欧洲肿瘤研究所和米兰比可卡大学的研究人员通过对涉及11000多人的临床试验进行荟萃分析(meta-analysis),发现接受免疫检查点抑制剂治疗晚期癌症的女性患者从中获得的益处要少于男性患者。相关研究结果于2018年3月16日在线发 表在Lancet Oncology期刊上,论文标题为“Cancer immunotherapy efficacy and patients' sex: a systematic review and meta-analysis”。
免疫检查点抑制剂通过抑制免疫反应而发挥作用,并且已知会改善转移性癌症患者的治疗结果。为了观察免疫检查点抑制剂是否会对男性患者和女性患者产生不同的影响,这些研究人员收集了20项临床试验的结果,这些临床试验涉及给予患上黑色素瘤、肾细胞癌、尿路 上皮癌、头颈癌和肺癌之一的患者服用四种药物中的任何一种。这四种药物分别是作为CTLA-4抑制剂的易普利姆玛(ipilimumab)和tremelimumab,以及作为PD-1抑制剂的派姆单抗(pembrolizumab)和纳武单抗(nivolumab)。
尽管相比于没有接受治疗的患者,这些免疫检查点抑制剂提高了男性患者和女性患者的生存机会,但是男性患者看到更大的益处。相比于未接受免疫检查点抑制剂治疗的女性患者,用于描述死亡风险的危害比(hazard ratio)在接受免疫检查点抑制剂治疗的女性患者中 为0.86,然而危险比在接受免疫检查点抑制剂治疗的男性患者当中为0.72,这意味着相比于未接受免疫检查点抑制剂治疗的男性患者,他们具有下降的死亡风险;相比于接受免疫检查点抑制剂治疗的女性患者,他们具有幅度更大的死亡风险。
6.Nat Med:肿瘤抑制基因ARID1a或能作为免疫疗法疗效的新型生物标志物
doi:10.1038/s41591-018-0012-z
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自德克萨斯大学MD安德森癌症中心的科学家们通过研究发现,一种频繁突变的肿瘤抑制基因—ARID1a的功能性缺失或会诱发正常DNA修复功能的缺失,并且促进肿瘤对免疫检查点抑制剂疗法变得敏感,前期 研究结果表明,ARID1a的突变或能帮助有效预测免疫疗法的成功性。
文章中,研究人员首次阐明了ARID1a在调节DNA错配修复(MMR)上扮演的关键角色,DNA的错配修复时细胞纠正DNA损伤的正常过程;研究者指出,利用靶向作用PD-1的免疫检查点抑制剂疗法或能成功减轻机体的肿瘤负担,并且延长携带ARID1a缺失肿瘤的小鼠模型的寿命 。ARID1a的突变频发于广泛的癌症类型中,尤其是在某些类型的癌症中常常突变频率较高(15%-50%),比如卵巢癌、子宫内膜癌、胃癌和膀胱癌等,然而大部分突变都会诱发ARID1a功能的缺失,从而就使其成为了一个不太理想的治疗靶点。
7.Front Immuno:突破性研究或解释了为什么PD-1肿瘤免疫治疗事与愿违!
doi:10.3389/fimmu.2017.01289; doi:10.3389/fimmu.2018.00012
来自阿尔伯塔大学的科学家关于PD-1的研究也许解释了为什么它会发生错乱导致1型糖尿病这样的自身免疫疾病。
图片来源:University of Alberta
“PD-1在近年来吸引了大量的注意力,是癌症免疫治疗的新靶标——理论就是通过关闭PD-1,就可以释放免疫系统攻击癌细胞,但是对于它如何发挥作用却没有深入的研究。”来自阿尔伯塔大学的Colin Anderson医生说道,他是阿尔伯塔糖尿病和移植研究所外科医生。 他的研究团队的第一项研究表明在胎儿或者新生儿期PD-1就可以调节免疫系统(T细胞)。“在我们的研究中,我们发现PD-1在T细胞经过两个学习不攻击机体自身健康细胞的阶段也是很重要的。”第一个阶段是T细胞在胸腺中被创造的时候,第二个阶段发生在它们迁移至 全身的时候,会经历一个叫做外周耐受的阶段。
该研究团队最近的研究表明T细胞从胸腺中释放出来但是还没完成第二个学习阶段的这段时间里,它们很可能引起自身免疫疾病,尤其是在没有PD-1的情况下。
8.NEJM:重磅!派姆单抗大放异彩!作为辅助疗法显著延长3期高危黑素瘤病人无复发生存期!
doi:10.1056/NEJMoa1801005
根据一项最新发表在《New England Journal of Medicine》上的研究,和安慰剂相比,派姆单抗作为一种辅助治疗可以显著延长高风险3期黑素瘤病人的无复发生存期。这项研究同时在美国癌症研究协会年会上进行了展示。
来自法国巴黎古斯塔夫?鲁西癌症校园的Alexander M.M. Eggermont及其同事将完全切除的3期黑素瘤病人随机分为两组:一组(514人)接受200 mg派姆单抗治疗,另一组(505人)接受安慰剂治疗,每三周注射一次,共18次。
研究人员发现在所有的治疗病人中,与安慰剂相比,派姆单抗与无复发生存期显著延长相关(一年无复发率75.4% vs 61.0%,复发或者死亡风险比率,0.57)。这种相关性也可以在853个病人中的PD-1阳性肿瘤组观察到(一年无复发率77.1% vs 62.6%,复发或者死亡风险 比率,0.54)。总体而言,派姆单抗和安慰剂组分别有14.7%和3.4%的病人发生了与治疗相关的3-5级严重副作用。派母单抗组发生一例与治疗相关的死亡。
9.Lancet Oncology:肿瘤免疫疗法治疗肺癌取得新进展
doi:10.1016/S1470-2045(18)30148-7
最近一项肺癌临床试验结果表明新型的免疫联合疗法组合对于控制非小细胞肺癌的进展具有显著的效果,相关结果发表在最近一期的《Lancet Oncology》杂志上。
患有恶性非小细胞肺癌的患者在化疗之后往往会出现复发的情况,因此很多患者会选择接受免疫疗法。其中一类免疫治疗药物叫做"检查点"抑制剂,这类药物能够靶向免疫系统的检查点分子调控机体的免疫反应,从而使得其对癌细胞产生更强的杀伤力。
在这项研究中,作者结合了检查点药物nivolumab以及另外一类强力的免疫刺激分子ALT-803."我们临床试验的独特性在于将两种完全不同的药物结合在一起使用。试验结果表明这些药物具有足够的安全性,而且相比单独的检查点疗法能够起到更佳的效果"。
10.JEM:突破!激活T细胞提高显著改善免疫检查点疗法和T细胞疗法!
doi:10.1084/jem.20171068
改善体内高度特异性的免疫战士——T细胞能力以攻击癌症的肿瘤免疫治疗在临床上取得了长足的进展。然而这种方法只在10-30%的病人身上有效,原因之一就是T细胞耗竭,这种情况是由于T细胞在肿瘤微环境种被反复刺激,最终失去了杀伤肿瘤的能力。来自匹兹堡大学 医学院和医学中心(UPMC)的新研究表明靶向治疗的同时防止或者逆转这种代谢上的耗竭可以增强免疫治疗,可能有助于免疫疗法帮助更多的人。
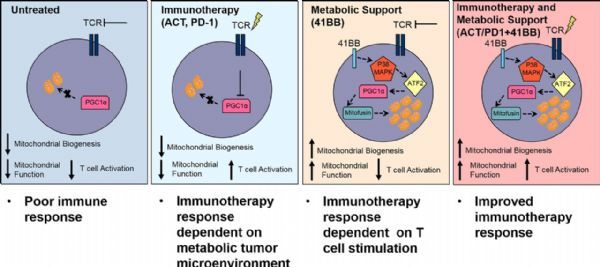
图片来源:JEM
这项研究于近日发表在《Journal Experimental Medicine》上,该研究通过揭示T细胞表面一个叫做41BB的蛋白质的工作原理导致了这些发现。41BB是T细胞在对抗感染时激活的一个共刺激因子,但是肿瘤内部的环境使它失活。过去的研究发现激活41BB可以帮助T细胞复 制并长时间维持,但是还不清楚它如何发挥作用。
在实验
上一篇:Cell Rep:不用运动也不用降低盐摄入,增加体内的β-羟基丁酸水平降低高血压有...
下一篇:研究揭示人类病原真菌感染孢子形成的细胞命运决定机制...
上海展辉生物技术有限公司
地址:上海市浦东新区东方路
联系电话:400-689-6719
联系邮箱:3369352092@qq.com
联系我们:
4006896719

扫一扫
关注东洪博元更多动态