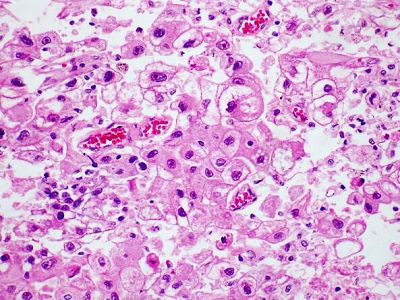
肝癌领域相关研究进展一览
1.科学家发现防止肝损伤恶化为肝癌的新靶标
DOI: 10.1172/JCI98156.
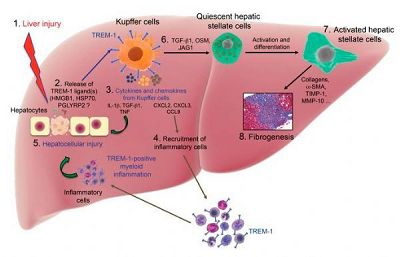
所有组织发生损伤或者压力时都会产生炎症,炎症也是肝纤维化的关键过程。靶向慢性失控的炎症是防止肝损伤和纤维化进展的一种策略。而近日来自奥古斯塔大学的研究人员发现髓样细胞触发性受体1(TREM1),一个炎症放大因子会通过加剧肝脏炎症和肝纤维化而促进肝病进展。
在肝脏中,TREM-1只在肝脏巨噬细胞和单核细胞中表达,而在四氯化碳诱导的慢性肝损伤和纤维化小鼠模型中,肝脏枯否细胞、循环单核细胞及单核细胞来源的巨噬细胞上高表达。TREM-1信号促使炎前信号因子产生并使炎症细胞滞留在损伤部位。
清除TREM-1可以降低肝损伤、炎症细胞浸润以及肝纤维化。而利用表达TREM-1的枯否细胞重建的TREM-1缺陷的小鼠却会维持招募炎症细胞和肝损伤。
研究人员还发现肝纤维化病人纤维化区域浸润的TREM-1阳性的枯否细胞和单核巨噬细胞数量显著增加。
总体而言,这些研究结果表明TREM-1在肝损伤和肝纤维化中扮演重要角色,TREM-1是枯否细胞激活的关键调节因子,会加剧慢性肝脏炎症反应、活化肝卫星细胞,因此该研究揭示了一种促进肝纤维化的新机制。
2. PLoS Biology:科学家发现肝癌细胞特殊“开关” 未来有望开发新型肝癌疗法
DOI: 10.1371/journal.pbio.2005599
近日,一项刊登在国际杂志PLOS Biology上的研究报告中,来自帝国理工学院的研究人员通过研究发现了一种新型的细胞机制或能用来靶向作用肿瘤组织;这种新发现的“开关”能够控制两种蛋白质的活性,即肿瘤抑制子DLC1(deleted in liver cancer-1)和talin蛋白,这两种蛋白质均能控制癌细胞是否会扩散到机体其它部位,但目前研究人员并不清楚这两种蛋白质的具体作用机制。
这项研究中,研究人员通过研究发现,talin蛋白随着运动而不断展开的方式或许是DLC1活性的决定因素,因此其在肝细胞癌的发生过程中非常重要。在合适的条件下,比如特定的基因激活或机体免疫系统功能下降时,癌细胞就会迁移或转移到其它组织中去,从而就会促进癌症扩散,一旦癌症扩散到机体的次级位点,研究人员就很难应对了,因此,有效预防癌症是研究人员首先要进行的。
该研究能帮助研究人员理解肿瘤细胞迁移的方式,同时也能为研究人员寻找有效的手段来靶向作用并抑制癌症的扩散,尤其是肝细胞癌;研究者Hernandez说道,我们的研究结果对于多项研究领域都具有一定意义,比如组织工程学、癌症研究、利用芯片进行的药物试验。
蛋白质的性能
就像被外力控制的骨架一样,细胞也能对外力产生反应进而收缩和移动,诸如细胞骨架能内部结构能够产生一定的力量来帮助癌细胞进行细胞迁移。talin蛋白能吸附到细胞膜,并在细胞内外构筑“一座桥”,其会像弹簧一样盘绕着,以便能够及时感知并对机械力产生反应。这些力量就会改变talin蛋白的形状,从而使得DLC1失活,以便其DLC1无法控制肿瘤抑制功能,从而就能促进癌症进展,目前研究人员并不清楚talin蛋白如何完成形状改变这个过程。
研究人员对成纤维细胞中talin蛋白对运动产生反应的模式进行了研究,成纤维细胞能够帮助愈合伤口并且修复损伤的组织,如果不施加抑制作用的话,成纤维细胞就会在肝脏中产生疤痕组织,从而诱发肝硬化和肝细胞癌。下一步研究人员将深入探究上述两种蛋白质的具体应用价值,尽管目前研究人员仅在成纤维细胞中进行了相应研究,但本文研究中研究者所发现的所有分子在全身都能找到,后期研究人员希望能在其它组织中阐明这些蛋白发挥作用的机制。
3.美国肝癌死亡率16年上升了44%,中国呢?
根据美国疾病防控中心(CDC)的一项最新报告,过去16年间美国肝癌死亡率上升了43%。
这项研究收集了美国2000-2016年间25岁以上成年人的信息。在此期间,肝癌从2000年的第九大致死癌症变成为2016年的第六大致死癌症。
“我认为死亡率如此急剧上升是很令人吃惊的。”拉什大学医学中心肿瘤外科主任Sam G. Pappas博士说道。
在50个州中,华盛顿的死亡率最高,佛蒙特州的死亡率最低。
同时此期间全国更多的男性死于肝癌,男性的死亡率是女性死亡率的2-2.5倍。
肝癌发病率升高最多的年龄段是55-64岁,从2000年至2013年间上升了109%,此后保持平稳。
梅奥诊所的研究人员表示,肝癌的风险因素包括HBV或者HCV的慢性感染、肝硬化、遗传性肝病以及过量饮酒。
Pappas表示这些数据表明现在需要对肝癌高风险人群进行早期筛查。这些病人应该规律地看医生,咨询风险因素并进行规律的检查。
“肥胖也是一个重要的风险因素,但是常常被忽视。”他补充道。长期肥胖会导致脂肪肝,而这是肝损伤的第一大诱因。
4.Nature子刊: 发现儿童恶性肝癌的潜在治疗靶点
DOI: 10.1038/s42003-018-0077-8
肝母细胞瘤(Hepatoblastoma,HBL)是一种在孩子3岁前发病的恶性儿科肝癌。肝癌中常见的一种现象是肿瘤抑制蛋白(tumor suppressor proteins ,TSPs)减少。
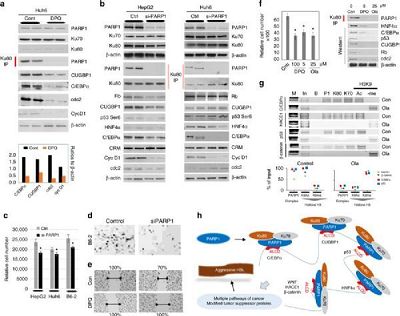
但是在一项最近发表于nature子刊《Communications Biology》的研究中,研究人员却发现侵袭、耐药的HBLs中的TSPs水平升高。通常来讲,经典表型的HBL病人的TSP水平会降低,但是患侵袭性HBL的病人的TSPs水平会升高,这些TSPs经历过转录后修饰,导致其抑制癌症的活性消失。
在该研究中,研究人员发现侵袭性HBL病人体内特殊的侵袭肝癌结构域(aggressive liver cancer domains,ALCDs)会被PARP1介导的染色体重塑过程激活,导致修饰过的TSPs表达升高以及额外的癌信号通路激活:WNT信号通路和beta-连环蛋白。而抑制PARP1可以抑制ALCDs活化并使相应基因的表达恢复正常,从而降低细胞的增殖。
该研究表明PARP1激活是侵袭性HBL发展的一种机制,也进一步表明FDA已经批准的PARP1抑制剂也许可以用于治疗患侵袭性HBL的病人。
5.J Immunol:肺部气道细胞或能促进肝癌细胞向肺部扩散
DOI: 10.4049/jimmunol.1700544
肝细胞癌(HCC)是一种最常见的肝癌,其也是全球引发癌症患者死亡的第三大原因,尽管肝细胞癌患者能从多种诊断和疗法中获益,但其平均寿命仍仅有16.2个月,而癌细胞扩散到肺部的患者的生存期仅有不到6个月时间。当肿瘤细胞从肝脏进入到血液中就预示着癌症肺转移开始了,这个过程涉及了一系列肿瘤和宿主之间的细胞反应,但目前研究人员并不确定其中所涉及的具体分子机制。
近日,一项刊登在国际杂志the Journal of Immunology上的研究报告中,来自日本金泽大学的科学家们通过研究详细调查了肺部中两种不同类型的白细胞(巨噬细胞)及和癌症转移小鼠模型炎症相关的多种分子在肺部中所扮演的关键角色,相关研究或为后期开发有效抑制癌症的新型疗法提供了新的思路和希望。
通过将小鼠的肝细胞癌细胞系注射到小鼠静脉中就能制造出用作研究的动物模型,从而也能促进小型转移性肺部结节的生长,其生长模式能够模拟人类肝细胞癌的肺部转移过程,通过监测癌细胞的转移,研究人员在小鼠肺部中检测到了两种类型的巨噬细胞,即间质巨噬细胞(IMs)和肺泡巨噬细胞(AMs)。
研究者Takuto Nosaka说道,间质巨噬细胞来自机体的循环系统,而且其能促进肺部肿瘤的生存和生长;相反,肺泡巨噬细胞则来自肺部肺泡的内衬组织,其主要参与癌细胞的转移,但其在肺部转移中所扮演的具体角色研究人员并不清楚,但研究者们在模型中观察到肺泡巨噬细胞水平的增加或许就能够证明其在疾病发生过程中所扮演的关键角色。
相比间质巨噬细胞而言,小鼠肺结节周围的肺泡巨噬细胞能够产生较多的炎性脂质白三烯B4(LTB4),LTB4能激活免疫细胞,直接促进人类和小鼠癌细胞增殖和侵袭能力,包括肝细胞癌细胞,肺泡巨噬细胞则能直接通过LTB4的分泌来促进转移性肺部结节部位肿瘤细胞的生长。
下一步研究人员将会重点研究血液中的肺泡巨噬细胞如何被招募到肺部组织中,以及间质巨噬细胞如何控制上述过程,间质巨噬细胞能表达信号分子CLL2,而其受体CCR2能被肺泡巨噬细胞所表达,将上述两种分子进行结合或能控制肺泡巨噬细胞的积累。
间质巨噬细胞和肺泡巨噬细胞的相互作用能够通过LTB4的产生来促进癌细胞肺部转移的进展,这或为研究人员提供了一种潜在的靶点来开发治疗癌症转移的新型疗法。
6.Hepatology:南昌大学学者发现泛素样蛋白破坏底物mRNA和蛋白一致性促进肝癌进展
doi.org/10.1002/hep.30105
最近,关于转录组-蛋白质组关系的研究表明某些基因存在mRNA/蛋白质表达的不一致,究其原因可能与蛋白质的翻译后修饰有关。但是目前仍然没有证据支持这一假设。Wnt诱导分泌蛋白1(WISP1)是β-catenin的下游靶基因,在肿瘤发生和进展过程中发挥重要作用,但是WISP1在不同肿瘤类型中的表达和作用并不一致。最近来自南昌大学的研究人员发现WISP1的一种蛋白翻译后修饰导致该蛋白发生蛋白/mRNA表达不一致,并进而影响肝细胞癌进展。相关研究结果发表在国际学术期刊Hepatology上。
在这项研究中,研究人员首先证实WISP1在肝细胞癌组织中显著下调,是HCC病人不良预后的一个独立预测因子,并且体内和体外实验的证据均表明WISP1能够抑制HCC细胞的增殖。更进一步的研究发现WISP1的低表达与FAT10的表达有关,FAT10是一个泛素样蛋白,既可以发挥促进蛋白降解的功能也可以起到稳定作用,是参与蛋白翻译后修饰的一个重要蛋白。
研究人员发现FAT10的过表达能够通过FAT10修饰(FAT10ylation)促进WISP1降解进而降低WISP1表达促进HCC细胞增殖。有趣的是,研究人员还发现FAT10过表达会导致WISP1发生蛋白/mRNA表达的不一致,出现WISP1蛋白水平下降而mRNA水平增加的情况。研究人员对其中的机制进行了研究发现FAT10能够同时发挥促进底物稳定和促进底物降解的功能,FAT10过表达会通过稳定beta-catenin促进WISP1 mRNA表达,并直接促进WISP1蛋白发生降解。总的来说,这些结果表明FAT10过表达会导致WISP1出现mRNA和蛋白表达的不一致,因此通过下调WISP1的蛋白水平促进HCC进展。
7.Cancer Res:长征医院学者发现新的肝癌诊断标志物和潜在治疗靶点
DOI: 10.1158/0008-5472.CAN-17-3896
肝细胞癌(hepatocellular carcinoma,HCC)是一种高死亡率的原发性肝癌,也是肝硬化患者死亡的主要原因,肝癌的分子发病机制非常复杂且具有异质性,虽然经过多年努力,肝细胞癌的诊断和治疗都已经发生了重大变化,但仍然缺少稳定可靠的诊断标志物和治疗靶点。
SHP-1也叫做PTPN6,是一种非受体型蛋白酪氨酸磷酸酶,之前研究证明该分子作为炎症的负调控因子发挥作用。越来越多的证据表明SHP-1能够抑制肝细胞癌的进展,但是SHP-1在肝癌发生过程中的作用还不清楚。最近来自上海长征医院的研究人员在国际学术期刊Cancer Research上发表了他们的最新发现,提示SHP-1或可用作肝细胞癌诊断标志物,还有望成为治疗肝细胞癌的新靶点。
在这项研究中,研究人员发现SHP-1的表达水平在人肝细胞癌组织中显著下调,低于非癌变组织并且与肿瘤直径以及血清AFP水平呈负相关关系。SHP-1表达水平降低还与受HBV感染的肝细胞癌病人的整体生存时间更短存在相关性。
研究人员发现过表达SHP-1能够抑制肝癌细胞的增殖,迁移,侵袭和肿瘤形成能力,敲低SHP-1能够增强癌细胞的恶变表型,并且在肝脏细胞中敲除Ptpn6基因能够增强DEN诱导的肝癌形成以及原发肝癌的转移。更进一步的研究表明,通过腺病毒过表达SHP-1能够对肝癌小鼠模型发挥治疗作用。除此之外,研究人员还观察到SHP-1可以抑制JAK/STAT,NF-kB和AKT信号途径的激活,但是并不会影响肝细胞的MAPK信号途径。
总的来说,这些数据表明SHP-1是抑制肝癌发生和肝细胞癌进展的一个肿瘤抑制因子,SHP-1或可成为一个新的诊断标志物和治疗肝细胞癌的潜在靶点。
(本文来源生物谷)
想要了解更多请关注“中洪博元医学实验帮 ”