造血干细胞最新研究进展
2018年7月31日/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。(细胞培养)
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Nature:重磅!鉴定出导致血癌前疾病的遗传性变异和获得性突变
doi:10.1038/s41586-018-0321-x
克隆性造血(clonal hematopoiesis)是一种与年龄相关的白细胞病症。它与较高的某些血癌和心血管疾病风险相关联。在一项新的研究中,来自美国哈佛医学院和哈佛陈曾熙公共卫生学院等研究机构的研究人员鉴定出首批已知的遗传性基因变异中的一些基因变异能够显著增加一个人患上克隆性造血的几率。相关研究结果于2018年7月11日在线发表在Nature期刊上,论文标题为“Insights into clonal haematopoiesis from 8,342 mosaic chromosomal alterations”。论文通信作者为哈佛医学院的Po-Ru Loh、Giulio Genovese、Steven A. McCarroll和哈佛陈曾熙公共卫生学院的Alkes L. Price。
图片来自CC0 Public Domain。
McCarrol说,“克隆性造血越来越被认为是未来疾病风险的一种重要的生物标志物,但是我们并不知道它是由什么导致的。”他说,“这些发现揭示出遗传事件---一些遗传事件是遗传性的,其他的遗传事件是获得性的---发生的特定顺序导致这些异常的血细胞产生。”
这项研究还得出了令人吃惊的结论:遗传性基因变异和获得性突变之间要比之前所理解的存在着更多的关联性。人们一般认为获得性突变会随着时间的推移随机地发生,而且是自发性出现的或者是在接触紫外线等有害物质后出现的。但是,这些研究人员发现了一些例子,在这些例子中,遗传性基因变异导致在生命后期出现特定的获得性突变,或者让携带着获得性突变的细胞比其他细胞具有生长优势。
McCarroll 说,“从概念上讲,这项研究中最有趣的事情之一就是模糊了遗传性基因变异和获得性突变之间的区别。遗传的等位基因经证实对之前被认为是一个更加随机的过程产生了强大的影响。”
2.Nature:为何我们的造血干细胞存在于骨髓中?免受紫外线伤害是关键!
doi:doi:10.1038/s41586-018-0213-0
在人类和其他哺乳动物中,产生所有血细胞的造血干细胞位于骨髓中。但在鱼类中,造血干细胞存在于肾脏中。在20世纪70年代后期,生物学家们首次意识到血液在身体的特定部位---造血干细胞壁龛(blood stem cell niche)---中产生。从那时起,他们就一直想知道为何不同的生物在不同的部位中执行这种功能。
四十年后,来自美国哈佛大学干细胞与再生生物学系、波士顿儿童医院干细胞项目和哈佛干细胞研究所的研究人员在一项新的研究中发现了一条有价值的线索:这种造血干细胞壁龛经进化后保护造血干细胞免受阳光中有害紫外线(UV)的伤害。这种对造血干细胞壁龛的新认识将有助人们增强造血干细胞移植的安全性。相关研究结果于2018年6月13日在线发表在Nature期刊上,论文标题为“Protection from UV light is an evolutionarily conserved feature of the haematopoietic niche”。
3.Cell Rep:科学家鉴别出能有效维持造血干细胞功能的关键蛋白分子
doi:10.1016/j.celrep.2018.05.042
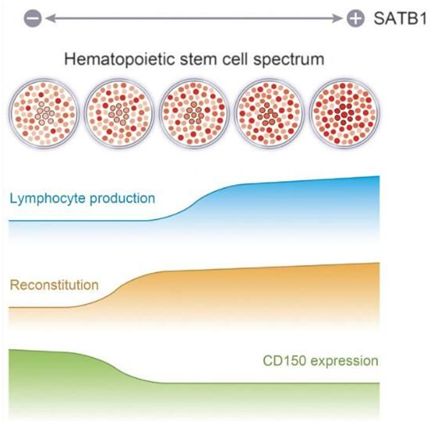
近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自日本大阪大学的科学家们通过研究发现了一种名为SATB1的特殊分子在造血干细胞分化成为淋巴细胞谱系上扮演着关键角色,SATB1,即富含AT的序列结合蛋白1(AT-rich Sequence Binding Protein 1),其是细胞核广泛的染色质组织者。
图片来源:Osaka University
文章中,研究人员通过对遗传工程化细胞和小鼠胚胎进行研究得到了上述结果,然而研究人员并未阐明成年人机体中这些生物学过程发生的分子机制,此外,研究者也并不清楚淋巴细胞谱系开始发生分化的机制和方式。研究者指出,SATB1的表达主要涉及造血干细胞自我更新能力的差异和其分化为淋巴细胞谱系的差异。
研究人员通过遗传工程操作制造出了造血细胞中SATB1缺失的小鼠以及报道小鼠,所谓报道小鼠,就是在内源性SATB1启动子的控制下能够表达红色荧光蛋白的小鼠,随后研究人员对小鼠进行研究证实了,SATB1能够帮助有效维持成年小鼠机体中造血干细胞的功能。研究者指出,SATB1的高表达和低表达在造血干细胞中均存在,而且造血干细胞自我更新期间SATB1的表达量也能够发生改变,此外,SATB1的高水平表达也能够促进造血干细胞拥有较强的淋巴细胞分化能力。
4.PNAS:科学家成功制造出人类骨髓组织
doi:10.1073/pnas.1805440115
日前,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自巴塞尔大学的研究人员通过研究开发了一种特殊的人工组织,其能够使得人类的血液干细胞在长时间内保持功能。
这项研究中,研究人员通过对人工骨髓生境进行工程化操作,从而就能使得干细胞和祖细胞能在较长的一段时间内繁殖。研究人员开发出的这种人工组织能够模拟天然骨髓生境中多种复杂的生物学特性,为了实现这一目标,研究人员将人类间质细胞与一种由多孔、骨质样的3D支架组成的陶瓷材料相结合,这种材料通常是一种灌注生物反应器,其能用来将生物性和化学性的材料相结合。
利用上述方法,研究人员就能够制造出覆盖着嵌入血细胞的细胞外基质结构,这种人工组织具有与天然骨髓生境相似分子结构,其就能创造出特殊环境来维持造血干细胞和祖细胞的功能。这种特殊技术能被用来生产剧透特殊分子特性的骨髓生境,同时还能选择性地结合或去除单个蛋白质,这或许就为研究人员提供了一系列可能性,包括研究影响人类机体血液形成的因子,对多种药物进行筛选来确定能预测患者对特殊疗法的反应。
5.Cell:突破!科学家利用CRISPR/Cas9改造造血干细胞 促进CAR-T细胞疗法有效治疗急性髓性白血病
doi:10.1016/j.cell.2018.05.013
造血干细胞,图片来自Harvard Medical School。
近日,一篇刊登在国际著名杂志Cell上的研究报告中,来自宾夕法尼亚大学佩雷尔曼医学院的科学家们通过研究开发出了一种新方法,能利用CAR-T细胞来治疗急性髓性白血病(AML),为了能治疗这种白血病,目前研究人员会靶向作用健康细胞中表达的一种名为CD33的特殊蛋白,也就意味着,这种疗法并不能在不造成患者其它正常骨髓损伤的情况下来成功攻击癌症,而本文研究中研究者所开发的新方法则利用基因编辑工具CRISPR/Cas9来移除健康造血干细胞中的CD33分子,从而攻击携带该分子的癌变细胞。
目前CAR-T疗法已经被FDA批准用来靶向作用表达CD19蛋白的细胞,比如治疗急性淋巴细胞白血病和非霍奇金淋巴瘤等,然而对于AML而言,CAR-T细胞疗法似乎并不是一种有效的治疗手段,因为AML癌细胞并不会表达CD19,因此研究人员就需要寻找其它潜在的作用靶点。 一个非常有潜力的例子就是CD33蛋白,此前研究人员尝试靶向作用该蛋白,却发现也会损伤患者体内的健康细胞,而制造一种短时效应的CAR-T细胞或许就能防止健康细胞被损伤,这或许就能“击败”CAR-T细胞疗法的最大优势,即能在体内循环,并且持续数年来保护患者疾病不复发。研究者Saar I. Gill博士说道,这种疗法似乎就是一种真正的“活体药物”(live drug),我们都知道CAR-T细胞能在患者体内存活多年,关闭其功能似乎会弄巧成拙。
而本文研究中,研究人员就利用CAR-T细胞为基础做出了一项巨大革新,开发出了安全且有效靶向作用白细胞的新型疗法,而这一研究的关键点就在于利用新一代基因编辑工具(CRISPR/Cas9)来完成新型抗原特异性免疫疗法的开发。由于“猎人细胞”(hunter cells)无法有效区分正常细胞和恶性细胞,因此研究人员就开发出了一种创新性方法来对正常干细胞进行遗传修饰,使其不再像白血病细胞一样,研究者利用CRISPR/Cas9工具移除了健康细胞的CD33分子,让他们不可思议的是,缺失CD33的健康干细胞同样能够发挥正常功能,这就使得CD33是白血病细胞的唯一标记了,而且CAR-T细胞疗法就能够轻松识别并且攻击癌细胞。
6.Cell Stem Cell:科学家鉴别出饮食压力状态下支持血细胞产生的特殊分子
doi:10.1016/j.stem.2018.04.002
位于骨髓中的造血干细胞(HSCs)能够调节血细胞的产生,当处于特定的压力状况下,比如炎症和衰老,造血干细胞的自我更新能力就会降低,日前,一项刊登于国际杂志Cell Stem Cell上的研究报告中,来自日本金泽大学(Kanazawa University)的科学家们通过研究阐明了Spred1分子在造血干细胞维持动态平衡(自我更新)中所扮演的关键角色,在摄入高脂肪饮食的小鼠体内,Spred1或能保护造血干细胞的稳态。
研究者表示,Spred1能够结合c-Kit分子,c-Kit主要参与一种能指导造血干细胞发育和调节的信号过程,对Spred1缺陷的小鼠进行实验后,研究人员发现,在没有压力的状况下Spred1对于正常的血细胞产生或许并不重要,此外,Spred1的缺失还会促进造血干细胞的自我更新,从而就能延长细胞的寿命,增加机体的竞争力并有效抵御生理性压力。
然而,当研究人员观察高脂肪饮食对Spred1缺陷的小鼠所产生的效应时,他们发现,饮食会诱导特殊血液癌症的发生,相关研究或许表明,Spred1在调节造血干细胞在体内平衡的过程中扮演着关键的角色。文章中,研究人员强调了Spred1与造血作用之间的复杂关联,同时他们还阐明了该蛋白质的功能也饮食压力之间的关系,研究者总结道,调查饮食因素在干细胞自我更新过程中的病理生理学角色,同时寻找有效的手段来操控Spred1所介导的造血干细胞自我更新的控制,或许就能帮助科学家们开发新型创新性技术来有效抑制饮食相关疾病的发生。
7.Science:挑战常规!维持骨髓造血干细胞所需的TPO蛋白竟由肝细胞产生
doi:10.1126/science.aap8861
造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。造血干细胞(HSC)一直被认为是所有血细胞的祖先。在我们出生后,这些多能性干细胞产生了我们的所有血细胞谱系:淋巴系细胞(lymphoid cell)、髓系细胞(myeloid)和红系细胞(erythroid cell)。
造血干细胞维持依赖于外在信号。当前,人们已证实来自骨髓的局部信号维持造血干细胞。然而,人们并不清楚的是全身因子(systemic factor)是否也起着维持造血干细胞的作用。在一项新的研究中,来自美国哥伦比亚大学医学中心的研究人员着重关注维持造血干细胞所必需的促血小板生成素(Thrombopoietin,TPO)分子。他们利用基因敲入小鼠证实TPO是由肝细胞产生的,而不是由骨髓细胞产生的,这一发现挑战了人们的常规看法:鉴于造血干细胞主要存在于骨髓中,人们的直接看法就是TPO是由骨髓产生的。相关研究结果发表在2018年4月6日的Science期刊上,论文标题为“Hepatic thrombopoietin is required for bone marrow hematopoietic stem cell maintenance”。
为了进一步证实这一点,这些研究人员剔除造血细胞、成骨细胞(osteoblast)或骨髓间充质细胞中的TPO表达并不影响造血干细胞的数量或功能。然而,当剔除肝细胞中的TPO表达时,骨髓中的造血干细胞会被耗尽。因此,肝脏中的肝细胞产生的循环TPO是一种跨器官因子,是维持骨髓中的造血干细胞所必需的。
这些结果证实除了骨髓局部的微环境之外,TPO等全身因子是维持骨髓中的造血干细胞的关键外来组分。
8.Cell:科学家阐明维持造血干细胞正常功能的关键分子机制
doi:10.1016/j.cell.2018.03.008
形成成熟血细胞的造血干细胞通常需要非常精确水平的蛋白质才能发挥作用,然而在特定类型的侵袭性血液癌症患者中,其蛋白质产生调节功能的缺失是非常常见的。日前,一项刊登在国际杂志Cell上的研究报告中,来自瑞典隆德大学的研究人员通过研究揭开了一种新型机制,这种机制能够有效控制蛋白的产生,从而指挥干细胞的功能。
Cristian Bellodi说道,理解RNA修饰的功能或许是一个让人非常激动人心的研究领域,如今我们依然并不清楚哪些RNA分子会被修饰以及RNA分子被修饰的分子机制,同时我们也不清楚是否这会影响机体细胞的重要生理学过程,因此,我们就很有必要深入研究机体细胞中特殊类型的化学修饰如何调节RNA的功能,从而就能帮助我们理解该修饰过程的异常表现如何诱发人类疾病的发生。
研究人员发现,当缺少负责对RNA进行假尿苷修饰的酶类PUS7后,干细胞就会产生异常水平的蛋白质,这种蛋白质的过量产生就会造成不平衡的干细胞生长,同时还会明显阻断血液细胞的正常分化过程。PUS7酶能将假尿苷修饰引入到之前未被描述的非编码蛋白质的RNA分子中,即miniTOGs (mTOGs)分子,假尿苷的存在能激活mTOGs分子强烈抑制干细胞蛋白质产生的机器功能,从而就能确保合适水平的蛋白质被制造产生。
(本文来源生物谷)
想要了解更多请关注“中洪博元医学实验帮”