2018年8月Cell期刊不得不看的亮点研究
1.Cell:暂时忘记流式细胞仪吧,科学家们开发出智能图像激活细胞分选技术
doi:10.1016/j.cell.2018.08.028
(流式细胞仪)(智能图像激活细胞分选技术)
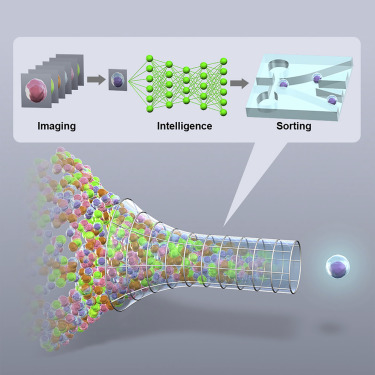
50多年来,基于流式细胞仪(flow cytometry)的细胞分选是依据细胞的表面标志物表达谱从物理上分离这些细胞,它已成为生物学实验室中的一种广泛使用的工具。但是,在一项新的研究中,来自一个国际研究团队揭示出这个关键过程的最新进展,即“智能图像激活细胞分选(Intelligent Image-Activated Cell Sorting, IACS)”。相关研究结果于2018年8月27日在线发表在Cell期刊上,论文标题为“Intelligent Image-Activated Cell Sorting”。
图片来自Cell, doi:10.1016/j.cell.2018.08.028。
IACS是一种智能机器,它集成了光学、微流体、电学、计算和机械技术,不仅可以根据细胞的全局表型谱,还可以利用一种图像驱动方法获得细胞的空间和形态特性来对这些细胞进行分选。这些研究人员将推出一种开放式创新平台,在这种平台上,用户可以在日本东京大学构建出的这种智能机器上提出想法和提交有趣的样本进行测试。另外,一家初创公司CYBO公司(CYBO Inc.)将把这种IACS技术转变为一种商业产品。
与所有流式细胞仪一样,将含有悬浮细胞样品的试管放置在注射口处,从而将它引导入这种IACS系统中。在运行过程中,让细胞逐个地在显微镜透镜下通过并进行成像;实时收集这些成像数据并用于制定分选决策,从而将符合标准的细胞与那些不符合标准的细胞在物理上分离开来。在完成分离后,收集一个含有经过分选的细胞样品部分的试管和一个含有剩余的细胞样品部分的试管,在在光学显微镜下检查这两个试管,并评价它们的产率和纯度。与流式细胞仪不同的是,细胞依据它们的空间和形态学参数(比如细胞内的蛋白定位和细胞间相互作用)从大的异质群体中分离出来。
Goda说,“这种平台即使采用深度学习算法,也能够在32毫秒内完成图像采集、图像处理、决策制定和驱动,从而实现以每秒约100个细胞的前所未有的速度进行实时的基于图像的智能细胞搜索和分选。这种IACS技术具有广泛的用途:能够处理从微生物学到血液学等各种领域的各种类型和大小的细胞,并有望在生物科学、制药和医学科学领域利用这种机器取得新的发现。”
2.Cell:重磅!首次揭示大脑血清素系统至少由两组血清素能神经元亚群组成
doi:10.1016/j.cell.2018.07.043
化学信使分子血清素(serotonin,也称作5-羟色胺)与从情绪到运动调节的一切相关。但是迄今为止,人们还远未明确血清素对哺乳动物大脑的影响。科学家们给出了不同的结果。一些人发现血清素能促进快乐。另一些发现它增加焦虑的同时抑制运动,而其他人持相反的观点。
在一项新的研究中,来自美国斯坦福大学的Liqun Luo教授及其团队着重关注脑干中的一个被称作中缝背核(dorsal raphe)的区域,这个区域含有哺乳动物大脑中最大密度的都通过释放血清素传递信号的神经元(大约9000个)。相关研究结果于2018年8月23日在线发表Cell期刊上,论文标题为“Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems”。
这些中缝背核神经元的神经纤维或者说轴突与很多至关重要的执行着一系列功能(包括思考、记忆、情绪和身体功能的调节)的前脑区域形成一个庞大的连接网络。通过注射感染这些区域中的血清素轴突(serotonin axon, 注:血清素能神经元的轴突)的病毒,这些研究人员能够将这些连接追溯到它们在中缝背侧中的原始神经元。
这允许他们构建出脑干中致密的血清素释放神经元(serotonin-releasing neuron, 也称作serotonin neuron,即血清素能神经元)到它们影响的多个前脑区域的神经投射的视觉图谱。这种图谱揭示出在中缝背核中至少存在着两组不同的血清素能神经元,它们与大脑中的皮层和皮层下区域相连。
更重要的是,这些研究人员发现血清素能神经元本身比之前想象的更加复杂。投射到皮层区域的血清素能神经元并不仅仅利用血清素传递信息,还会释放出一种叫做谷氨酸的化学信使,这让它们成为大脑中释放两种不同化学物质的少数神经元之一。这就产生一个问题,即人们是否应当称呼它们为血清素能神经元,毕竟神经元是根据它们释放的神经递质命名的。
总之,这些研究结果表明,大脑的血清素系统不是由同质的神经元群组成,而是由许多协同发挥作用的神经元亚群(或者说子系统)组成。Luo团队鉴定出两组神经元亚群,但可能存在着更多组的神经元亚群。
3.Cell:大肠杆菌竟促进宿主的铁吸收能力
doi:10.1016/j.cell.2018.07.032
在一项新的研究中,美国科罗拉多大学波德分校的Bin Qi和Min Han证实作为一种导致食物中毒或从宿主身上偷走营养物的病原体而广为人所知的大肠杆菌实际上通过产生一种帮助细胞摄取铁的化合物在促进宿主健康中发挥着关键性作用。这项研究揭示出大肠杆菌让它的宿主受益的机制,这可能最终导致人们开发出最有效地治疗影响着全世界10亿多人的缺铁性贫血(iron deficiency anemia)的方法。相关研究结果于2018年8月23日在线发表在Cell期刊上,论文标题为“Microbial Siderophore Enterobactin Promotes Mitochondrial Iron Uptake and Development of the Host via Interaction with ATP Synthase”。
图片来自Cell, doi:10.1016/j.cell.2018.07.032。
这项研究起始于利用秀丽隐杆线虫(一种天然地富含大肠杆菌的线虫)开展的一系列实验。当给年轻的线虫喂食经过基因改造后不能够产生一种被称作肠杆菌素(enterobactin)的化合物的大肠杆菌时,它们生长缓慢而且它们体内的铁水平比较低。当将肠杆菌素重新导入这些线虫时,它们恢复自然的生长速度,而且它们体内的铁水平上升。
在线虫和人细胞中的进一步实验证实往饮食中添加肠杆菌素,即便在没有加入铁的情形下,也会显著地增加细胞中的铁水平。
科学家们长期以来一直认为大肠杆菌产生肠杆菌素旨在寻找铁用于它自身的存活和增殖。但是他们猜测为了这个目的,它从它的宿主中偷取铁,这经常被描述为“铁战争(iron tug of war)”。但是这项新的研究挑战了这一常规看法,提出肠杆菌素也结合到一种位于宿主线粒体内部的被称作ATP合酶(ATP synthase)的蛋白上,从而将铁吸入到宿主细胞中。
4.Cell:三维环境是细胞染色体分离的关键
doi:10.1016/j.cell.2018.07.042
科学家经常在塑料培养皿上平层地培养细胞。以这种方式培养的肝细胞在细胞分裂过程中分配它们的染色体方面是非常糟糕的。肝细胞不会在两个子细胞之间平均地分配染色体。这种错误可能会破坏细胞的遗传物质,这可能会让在实验室培养肝脏充满挑战。培养肝脏是再生医学的最高目标。也会没有人能够做到这一点,这是因为在培养皿中培养的肝细胞变得如此混乱以至于它们不会正常地发挥作用。
在一项新的研究中,来自美国麻省理工学院和瑞士联邦理工学院的研究人员比较了在培养皿中培养的肝细胞发生的分裂和小鼠体内的肝细胞发生的分裂。正如所料,染色体错误在实验室培养皿中培养的小鼠肝细胞中堆积着。但是,当这些研究人员观察小鼠肝脏内生长的细胞时,某些染色体分离缺陷并未发生。对肝细胞等一些细胞而言,环境就是一切。因此,从原生环境中分离出的细胞在体外无法正确地分离它们的染色体。相关研究结果于2018年8月23日在线发表在Cell期刊上,论文标题为“Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture”。论文通信作者为麻省理工学院的Angelika Amon和Kristin Knouse。
这也适用于其他的细胞类型。这些研究人员发现,来自小鼠乳腺和皮肤的细胞在染色体分离方面表现出类似的差异,这取决于它们的环境。这些结果提示着组织提供的外力有助于引导每个细胞内的染色体分离。
5.Cell:令人意外!细菌DNA遭受压缩时仍保持它的基因表达
doi:10.1016/j.cell.2018.06.049
细菌引起许多严重疾病,如食物中毒和肺炎。科学家们面临的挑战是,引起疾病的细菌是非常有弹性的。比如,当诸如大肠杆菌之类的细菌经历饥饿时,它们会大规模地重新组装它们的DNA,从而使得它们能够在应激条件下存活下来。 为了实现这一壮举及提高存活机会,大肠杆菌菌株显著增加一种被称作Dps的蛋白的数量。这种蛋白将细菌DNA压缩成致密的水晶状复合物并保护其免受损伤。虽然之前的研究已表明Dps保护细菌免受饥饿和其他的应激因素,但是科学家们并不知道这种特殊的蛋白是如何发挥作用的。
在一项新的研究中,来自荷兰卡夫利纳米科学研究所、格罗宁根大学、代尔夫特理工大学、美国罗彻斯特大学和俄亥俄州立大学的研究人员描述了Dps有助细菌在应激条件下存活下来的一些独特的特征。相关研究结果发表在2018年8月23日的Cell期刊上,论文标题为“Global DNA Compaction in Stationary-Phase Bacteria Does Not Affect Transcription”。论文通信作者为罗彻斯特大学生物学副教授Anne Meyer、夫利纳米科学研究所的Elio Abbondanzieri和Nynke Dekker。
植物和动物等高等生物中的细胞不含有Dps。然而,它们也会做类似的事情。当它们不需要基因组的某些片段时,它们会包裹这些片段并进行压缩。这种压缩能够有助让DNA免受损伤,这是因为这会将DNA与细胞质的其他部分隔离开来。每当DNA在高等生物中遭受压缩时,处于压缩的基因组片段中的基因就更不可能表达。这些研究人员原本认为当细菌DNA被Dps压缩时,他们会在细菌(一种低等生物)中观察到同样的效果。
但是,实际上,这些研究人员观察到令人吃惊的结果:尽管Dps确实会压缩细菌DNA,但是这种压缩并不对基因表达产生任何影响。当遭受应激时,不论DNA是否被Dps压缩,作为一种对基因进行转录的酶,RNA聚合酶(RNAP)能够结合到DNA上,仍然能够表达基因。大肠杆菌是他们观察到的尽管DNA遭受强烈的压缩但是基因表达没有发生变化的首个细菌。
这些研究人员观察到尽管RNA聚合酶仍然能够完全接触到遭受Dps压缩的DNA,但是其他的能够切割和破坏DNA的蛋白被完全阻断。因此,他们猜测Dps压缩细菌DNA的目的可能是保护它免受破坏或突变,同时仍然允许细菌表达有助于其抵抗应激条件的基因。
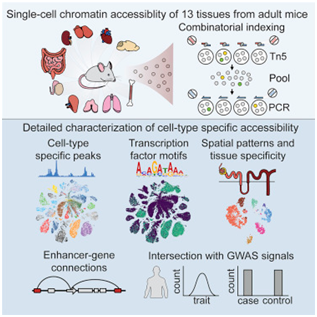
6.Cell:重大进展!首次构建出哺乳动物单细胞染色质可接近性图谱
doi:10.1016/j.cell.2018.06.052
科学家们对DNA缠绕和包装到所谓的染色质中的方式感兴趣,这是因为这会影响每个细胞中可用到的遗传信息。DNA就像串在一根绳子上的念珠。在这些分子“念珠”移动的地方会有空间形成,这样蛋白就能够访问和“读取”遗传信息。这种状态或者说这种基因组特征就是染色质可接近性(chromatin accessibility, 也译作染色质开放性)。
在一项新的研究中,来自美国华盛顿大学的研究人员利用他们之前开发出的一种被称作sci-ATAC-seq的测定方法分析了来自13种成年雄性小鼠组织的近10万个细胞。这些组织是骨髓、大肠、心脏、肾脏、肝脏、肺部、小肠、脾脏、睾丸、胸腺、全脑、小脑和大脑前额皮层。相关研究结果发表在2018年8月23日的Cell期刊上,论文标题为“A Single-Cell Atlas of In Vivo Mammalian Chromatin Accessibility”。论文通信作者为华盛顿大学的Cole Trapnell和Jay Shendure。
图片来自Cell, doi:10.1016/j.cell.2018.06.052。
这些研究人员观察到85种不同的染色质可接近性模式,并且能够将大部分染色质可接近性模式分配给特定的细胞类型。他们还对40万多个潜在的调节元件进行目录编制。总体而言,他们能够鉴定出具有类似的染色质可接近性模式的细胞群体,随后对每个细胞群体进行研究以便筛选出不同的细胞类型。
7.Cell:挑战常规!细胞周期的G1期和G2期是非常类似的
doi:10.1016/j.cell.2018.03.065
我们体内的细胞通过一个四阶段过程进行增殖:在G1期间,细胞首先增加它们的质量并为DNA复制作好准备;在S期间,它们复制DNA;接下来,在G2期间,它们检查重复DNA的保真度并组装细胞分裂所需的材料;最终,在有丝分裂期间,它们对复制的染色体进行排列并进行分裂。从一个阶段过渡到下一个阶段是受到严格调节的,需要组装和分解各种蛋白复合物来执行许多不同的功能,包括提供细胞周期进展的分子检查点。
长期以来,科学家们认为细胞周期的G1期和G2期处于不同的调节控制通路中,但是在一项新的研究中,来自新加坡科技研究局(A*STAR)分子与细胞生物学研究所的P?r Nordlund及其同事们推翻了这个观点。他们发现在细胞周期的G1期和G2期中形成的蛋白复合物是非常类似的,这提示着当细胞没有活跃地复制遗传物质或进行自我分裂时,它本能地存在着一种默认的生化操作模式。相关研究结果近期发表在Cell期刊上,论文标题为“Modulation of Protein-Interaction States through the Cell Cycle”。
Nordlund和他的同事们分析了在细胞周期的4个阶段过渡期间在人血细胞中发现的所有蛋白之间的相互作用状态的动态变化。他们使用了Nordlund团队之前开发出的一种技术,即细胞热转移测定(Cellular Thermal Shift Assay, CETSA),它能够让科学家们区分哪些蛋白独立地存在着,哪些蛋白位于蛋白复合物中。
他们鉴定出750多种蛋白在细胞周期的某个时刻形成复合物或独立存在着。然而,大多数这些发生变化的蛋白相互作用状态在细胞周期的S期和有丝分裂期间发生,而不在细胞周期的G1期和G2期发生。
8.Cell:40年来首次,治愈急性白血病的方法近在咫尺
doi:10.1016/j.cell.2018.07.045
文章亮点:研究人员开发了一种同时靶向CKIα和CDK7/9的口服活性小分子抑制剂;晶体学分析为共靶向不同激酶的作用提供了结构基础;这种抑制剂可以选择性杀死AML前体细胞并治愈AML小鼠;治疗的机理包括p53激活以及超级增强子(super-enhancers,SE)关闭。 清除CKIα会导致p53激活,而CKIα降解是来那度胺治疗白血病前综合征的机理。而近日来自耶路撒冷希伯来大学的研究人员开发了一种CKIα抑制剂,可以同时靶向转录激酶CDK7和CDK9,因此可以增强CKIα诱导的p53激活效果及其抗白血病效果。
癌基因驱使的SEs对于抑制CDK7/9高度敏感。研究人员找到了原发性小鼠急性髓性白血病(AML)细胞中的多种新获得的SEs,研究人员发现这些抑制剂可以清除许多SEs,并倾向于抑制SE驱使的癌基因的转录延伸研究人员发现同时抑制CKIα和CDK7/9可以稳定p53,抑制白血病癌细胞的生存、维持增殖的癌基因驱使的SE,并诱发凋亡。
抑制剂可以选择性清除白血病前体细胞,这也就解释了这些抑制剂在保持造血功能的同时治愈白血病的潜能。
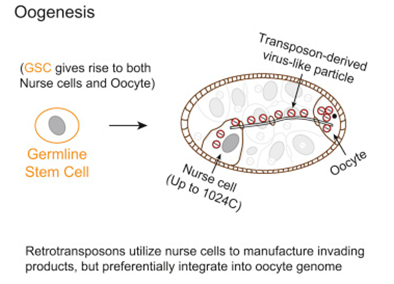
9.Cell:重大发现!跳跃基因劫持卵子发生大规模传播自身拷贝
doi:10.1016/j.cell.2018.06.040
我们的DNA序列中的将近一半是由跳跃基因(也被称为转座子)组成的。它们在发育中的卵细胞的基因组内跳跃,而且在进化中起着重要的作用。但是,它们的移动也会导致新的突变,从而引发血友病和癌症等疾病产生。值得注意的是,人们对它们在发育中的生殖细胞内移动的时间和地点知之甚少。毕竟,这是确保跳跃基因在后代中传播的关键过程,但也可能导致宿主患上遗传疾病。
为了解决这个问题,在一项新的研究中,来自美国卡内基科学研究所的研究人员开发了一种新技术来追踪跳跃基因移动。他们发现,在一个特定的卵子发育期间,一组被称作逆转录转座子(retrotransposon)的跳跃基因劫持了被称作哺育细胞(nurse cell)的特殊细胞,其中哺育细胞滋养着发育中的卵子。这些跳跃基因利用哺育细胞产生侵入性物质(它们自身的拷贝,也被称为病毒样颗粒),这些侵入性物质会迁移到附近的卵子中,随后被整合到这个卵子的DNA中。相关研究结果于2018年7月26日在线发表在Cell期刊上,论文标题为“Hijacking Oogenesis Enables Massive Propagation of LINE and Retroviral Transposons”。
图片来自Cell, doi:10.1016/j.cell.2018.06.040。
在这项新的研究中,这些研究人员以黑腹果蝇(Drosophila melanogaster)为研究对象,开发出追踪跳跃基因移动的方法。为了便于开展研究,他们破坏了piRNA抑制以增加这些跳跃基因的活性,然后在卵子发育过程中监测它们的移动。这导致他们发现了允许跳跃基因移动的策略。
论文通信作者、卡内基科学研究所研究员Zhao Zhang说,“我们非常吃惊地发现这些跳跃基因几乎不会在产生发育中的卵细胞的干细胞内移动,这可能是因为这些干细胞仅有两个基因组拷贝供这些跳跃基因使用。相反,这些跳跃基因使用起支持作用的哺育细胞,每个哺育细胞提供多达数千个基因组拷贝,这样它们就可作为大规模制造病毒样颗粒的工厂。不过,它们并没有整合到产生它们的哺育细胞中。相反,它们等待时机,直到它们被运送到与哺育细胞连接在一起的卵细胞中,在那里,跳跃基因的上百个新的自身拷贝被整合到卵子DNA中。我们的研究展示了寄生性遗传元件如何根据时间调整它们的活性和区分不同的细胞类型以便强劲地传播它们的自身拷贝、促进进化变化和导致疾病。”
10.Cell:科学家有望成功绘制出人类大脑神经系统详细图谱 或能阐明多种神经性疾病的发生根源
doi:10.1016/j.cell.2018.06.021
近日,一项刊登在国际杂志Cell上研究报告中,来自瑞典卡罗琳学院的研究人员通过研究绘制出了小鼠神经系统中多种细胞类型的系统且全面详细的图谱,该图谱或能为研究人员提供揭示机体神经性疾病起源的线索,此外,研究人员还能利用相同的方法来绘制出关于人类大脑的详细图谱。
这些研究人员利用小鼠作为模型系统,对哺乳动物机体神经系统的架构和组成进行了最大规模的研究,研究者最终共鉴别出了265种不同类型的细胞,同时还发现,神经元细胞的多样性甚至超过了200种。让研究人员非常不可思议的是大脑不同部位存在着多种特殊的不同类型的星状细胞,这或许就表明,这些星状细胞在大脑不同部位扮演着特殊的功能,而且其在大脑中所扮演的角色要比研究人员理解的更重要。
对大脑中不同类型细胞的研究或能帮助研究人员理解不用疾病的起源,大约三分之一的神经系统疾病是在胚胎发育过程中产生的,在过去15年里,研究人员进行大量遗传学研究鉴别出了诱发多种疾病的特殊致病基因,比如精神分裂症、多发性硬化症、自闭症、阿尔兹海默病和帕金森疾病等,然而根据相关基因表达的时间和地点,这些疾病常常都起源于一种特殊类型的细胞、一段特殊的区域或一个特定的时间点。
在这种新型神经系统图谱的帮助下,研究人员就能够在特殊类型的细胞中锁定致病基因,对于有效阐明疾病发生机制提供了新的线索,同时也能帮助研究人员开发出新型疗法来治疗相关的神经性疾病。对小鼠机体神经系统图谱的绘制是一项重大的研究进步,后期研究人员还将继续深入研究,利用相同的方法来绘制出人类大脑的详细图谱。(生物谷 Bioon.com)
相关新闻阅读:
2018年7月Cell期刊不得不看的亮点研究
(本文来源生物谷)
想要了解更多请关注“中洪博元医学实验帮 ”